Viết phương trình hóa học NH3 + N2H5Cl → NH4Cl + N2H4 phương trình phản ứng NH3 ra N2H4. Ở phương trình này khi cân bằng thì có cần nhiệt độ kèm theo hay có chất xúc tác tác động vào hay không, chúng ta cùng nhau đi tìm hiểu rõ để trả lời những câu hỏi có liên quan này nhé.
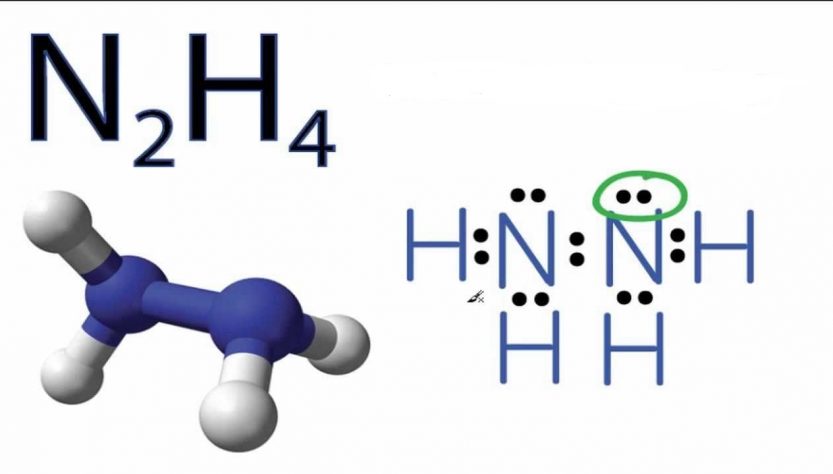
N2H4 là một hợp chất vô cơ với tên hóa học Hydrazine.
Hydrazine còn được gọi là Diamine hoặc Diazane hoặc Nitơ hydroxit và là một bazơ mạnh. Nó là một azane và không ổn định nguy hiểm. Mỗi tiểu đơn vị H2N-N là kim tự tháp và khoảng cách liên kết N−N là khoảng 1,45 Å.
Diamine ở dạng khan, là một chất lỏng dầu không màu, bốc khói có mùi như amoniac. Nó có giá trị điểm chớp nhoáng là 99 ° F. Trong trường hợp nếu có dấu vết không khí trong quá trình chưng cất, nó phát nổ. Nó độc hại và ăn mòn các mô. Khi nó trải qua quá trình đốtcháy , nó tạo ra các oxit độc hại của nitơ.
Phương trình hóa học xảy ra :
| NH3 | + | N2H5Cl | → | NH4Cl | + | N2H4 |
| amoniac | Hydrazin dihidroclorua | amoni clorua | Hydrazin | |||
| Bazơ | Muối |
Ở điều kiện nhiệt độ từ 150 – 190°C thì phản ứng từ NH3 tác dụng với N2H5Cl sẽ xảy ra.
Tiến hành thí nghiệm :
Ta cho NH3 tác dụng với N2H5Cl
Hiện tượng nhận biết
Trong phương trình này, bạn chỉ thường phải quan sát chất sản phẩm NH4Cl (amoni clorua), N2H4 (Hydrazin), được sinh ra
Hoặc bạn phải quan sát chất tham gia NH3 (amoniac), N2H5Cl (Hydrazin dihidroclorua), biến mất.
Ứng dụng của N2H4:
Hydrazine được sử dụng như một chất đẩy trong các phương tiện không gian.
Nó được sử dụng như một tiền thân trong một số sản phẩm dược phẩm.
Nó được sử dụng như một chất khử selen, asen và tellurium
Nó được sử dụng như một chất ức chế ăn mòn trong lò phản ứng nước làm mát.
Nó được sử dụng trong quá trình mạ điện phân của kim loại trên nhựa và thủy tinh.
Được sử dụng trong sản xuất hóa chất nông nghiệp.
Được sử dụng như một dung môi cho các hợp chất vô cơ.
Xem thêm các phương trình phản ứng của NH3 :
- 3H2O + 3NH3 + FeCl3 → 3NH4Cl + Fe(OH)3
- HO2 + NH3 → NH2 + H2O
- 3H2O + 3NH3 + Al(NO3)3 → Al(OH)3 + 3NH4NO3